CiPSC技术由来
多能干细胞(Pluripotent Stem Cells)是一类具有自我更新、自我复制能力的多潜能细胞,能够分化出多种人体细胞和组织。在细胞治疗、药物筛选和疾病模型等领域具有广泛的应用价值,是再生医学领域最为关键的“种子细胞”。
在蝾螈等动物体内,细胞具有强大的再生潜力,一旦组织遭受损伤,能够激活一套精密的再生基因程序促使细胞重建与修复。而哺乳动物的多潜能干细胞,只短暂存在于胚胎发育的早期阶段,随后很快会发育成身份与功能高度专业化的细胞,这更好地适应更为复杂的生命机能与组织稳定性,同时也限制了损伤后的自我修复能力。
如果能够通过特定方法,使高度分化的成体细胞重新获得类似胚胎发育早期的多潜能状态,那么就有可能制备出人的器官、组织、细胞,用于修补衰老、疾病、损伤或遗传带来的各类问题。如何逆转生命时钟,就是再生医学领域最重要的问题。

新一代诱导多潜能干细胞技术
1996年克隆羊多莉的诞生和1998年人胚胎干细胞系的首次建立震动了全世界。多莉的诞生证明,哺乳动物高度分化的体细胞也可以被逆转为早期胚胎的初始状态,并获得了发育为整个动物个体的能力。而人类干细胞的分离,也开启了对人类多潜能干细胞的研究。这让当时在国外学习免疫学的北启生物科学创始人邓宏魁决定转向再生医学领域。
2006年,日本科学家山中伸弥使用转基因的方式将小鼠成体细胞重编程为多潜能干细胞,称为诱导多潜能干细胞(induced pluripotent stem cell,iPS)。不需要经过胚胎发育,只需要放入调控基因表达的转录因子,就能将细胞的命运逆转。此后,人iPS细胞技术的建立为构建患者自体特异性干细胞系提供了全新的方法,大大加速了干细胞临床应用的进程。该技术于2012年荣获诺贝尔生理学或医学奖。
然而,Yamanaka的iPS诱导方案依赖于转基因技术且用病毒方法强行引入原癌基因,造成iPS细胞带有“原罪”,即基因组不稳定的问题,严重制约了其后续的转化和应用。
直到2013年,北启生物科学创始人邓宏魁教授课题组首次报道了完全通过小分子组合诱导小鼠体细胞重编程为多潜能干细胞(chemically induced pluripotent stem cells, CiPS)的方法,这种方法不依赖卵母细胞和转录因子等细胞内源物质,仅使用外源性化学小分子就可以逆转细胞命运。
这是人类第一次可以在不使用关键生物材料(如卵母细胞和转录因子)的情况下对细胞进行重编程。相比利用卵母细胞和转录因子的前两代技术,完全使用外源性化学小分子的重编程策略属于第三代技术,也是中国原创的底层技术。

2013,Science,邓宏魁研究团队发表全球第一篇仅使用化学小分子逆转“发育时钟”,
让小鼠体细胞重新获得多潜能性的研究。该研究开创了全新的体细胞重编程体系。
为了有效地调控细胞命运,需要协同调节多种信号和靶点。传统基于转录因子的重编程策略在协同调节的灵活度和作用时间方面都受到限制,而外源性的化学小分子不与基因组整合,可控性强,更为灵活,可以驱动细胞命运以分阶段的方式发生转变,能够提高可控性和标准化程度。
然而,人类作为高等动物,其成体细胞特性和稳态调控的复杂性远非小鼠成体细胞可比,在表观遗传层面上存在重重障碍,严重限制了在人类成体细胞中激发细胞可塑性的可能。自2013年以来,尽管众多国际团队在小鼠化学重编程工作的启发下进行大量尝试,却一直未能解决人类成体细胞的化学重编程问题。这使得领域内普遍认为:人类成体细胞的表观遗传限制是极其严格的,很可能无法通过化学重编程激发人类成体细胞获得多潜能性。
直到2022年,邓宏魁团队在Nature上发文,指出通过分步策略诱导,可以将人成体细胞重编程为多潜能性干细胞。这是首次在国际上报道完全使用化学小分子诱导人成体细胞转变为多潜能干细胞的案例。
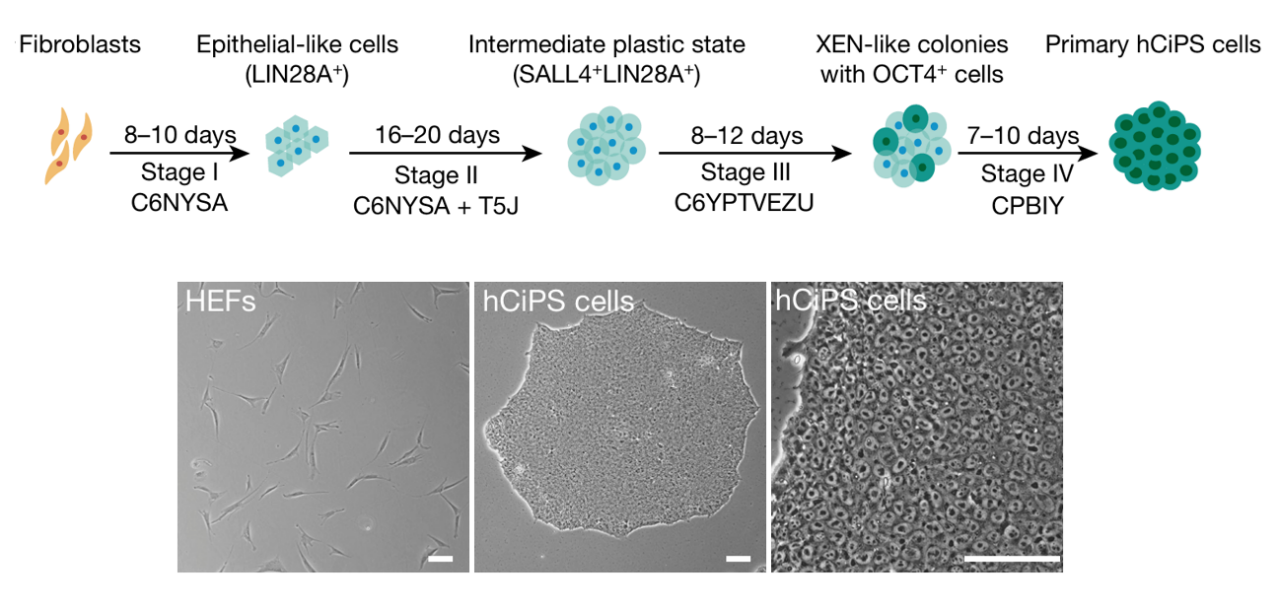
人体细胞化学重编程诱导人CiPS细胞
既然能够逆转细胞的生命时钟,让它回到早期状态,那么转换体细胞之间的类型也就成了可能,比如直接将皮肤细胞重编程为功能神经元,或者在体外制造一个人工肝来度过肝衰危险期。
因其可以精确调控细胞命运的功能,化学重编程有望成为高效制备各种功能细胞类型的通用技术。这会为治疗重大疾病开辟了新的途径,同样也是打开人类的再生医学的大门的关键。
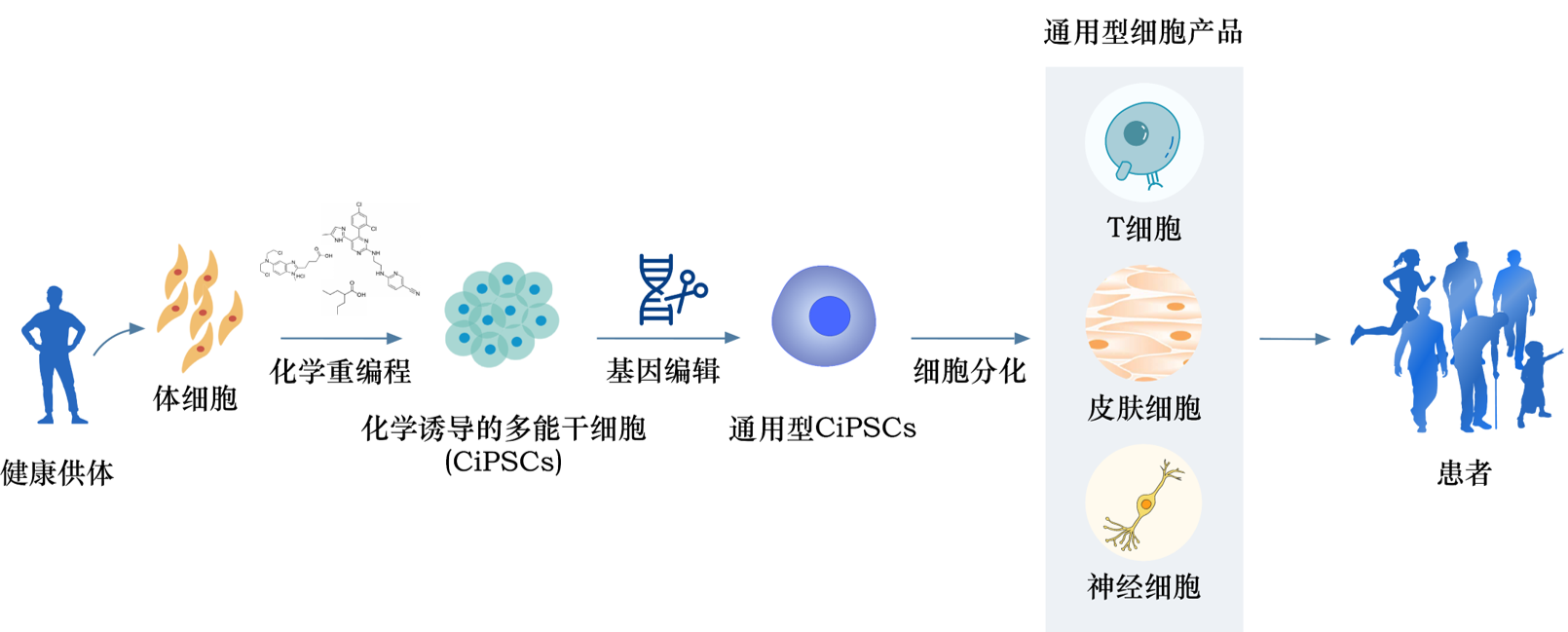
北启生物正在研发的通用型细胞产品
